Asymmetrische Induktion durch Lösungsmittel


Enantioselektivität ist die synthetische Herausforderung der organischen Chemie dieser Tage und ist daher Gegenstand zahlreicher Bücher und Übersichten [1-11].
Neben den synthetischen Interessen gibt es aber auch zahlreiche Ansätze, die die Erklärung des Ursprungs der biologischen Homochiralität im Blick haben[12-16 ]. Ein umfassender Artikel von Feringa gibt einen Überblick über die unterschiedlichen Versuche verschiedenster Wissenschaftler, dieses Mysterium zu entschleiern [17]. Von besonderem theoretischen Interesse sind in dieser Hinsicht auch die frühen Arbeiten zu autoinduzierten Prozessen, von denen Wynberg berichtet und nicht lineare katalytische Effekte, wie sie von Kagan beschrieben wurden, ebenso wie die von Soai beschriebenen autokatalytischen Reaktionen [18-22].
Im Vordergrund all dieser Betrachtungen steht die Frage, wie Chiralität übertragen und ggf. verstärkt werden kann.
Während die Literatur zur katalytischen Chiralitätsübertragung Bände füllt, ist wenig bekannt über asymmetrische Induktion bei Reaktionen in chiralen Lösungsmitteln; und das, obwohl Solventien organische Reaktionen und deren Produktverteilung in vieler Hinsicht beeinflussen [23]. Erste Versuche in den 70-ern zeigten zwar prinzipiell Erfolg, aber die erzielten Enantiomeren-Überschüsse waren mit wenigen Prozent äußerst gering und die photo- und elektrochemischen Reaktionen waren sehr speziell [24-27]. So wurde diese Synthese-Strategie bis Mitte dieses Jahrzehnts nicht weiterverfolgt; erst mit der Entdeckung chiraler ionischer Lösungsmitteln (CIL) wurde das Gebiet neu belebt [28,29]. So beschrieben Vo-Thanh et al. asymmetrische Induktionen in chiralen ionischen Lösungsmitteln bei Baylis-Hillmann Reaktionen mit ee-Werten (enantiomeric exces) bis zu 44% und Armstrong und Mitarbeitern gelangen enantioselektive Photoisomerisierungen mit bis zu 12% ee [30,31]. In den folgenden Jahren stellte sich die chirale Induktion durch Lösungsmittel als ein vitales Forschungsgebiet dar. Zwei bedeutende Arbeitsgruppen - Leitner vom Max Plank Institut für Kohlenforschung und Cheng von der Chinese Academy of Science - stellten ihre überaus interessanten Ergebnisse vor, die sie in chiralen ionischen Lösungsmitteln (CIL) erreichen konnten [32, 33]. Wieder war es die Baylis-Hillmann Reaktion - diesmal in der Aza-variante - mit der Leitner et. al. in Dimalatborat bei Umsätzen von 34-39% ee-Werte von 71-84% erreichte. Cheng und Mitarbeiter berichteten von Michael Additionen mit Nitroolefinen mit bis zu quantitativen Ausbeuten bei 99% ee.
Induktion durch S-Milchsäureester
Der Ansatz für unsere eigenen diesbezüglichen Arbeiten ging davon aus, dass auch kommerziell leicht zugängliche Stoffe des „natural chiral pool" effektiv asymmetrische Induktionen herbeiführen können. Dies ist nicht zuletzt auch deshalb interessant, weil Toxikologie und Ökotoxikologie der CIL ungeklärt erscheinen und Bedenken gegen ihre Nachhaltigkeit aufkommen [34-38]. Unsere ersten Arbeiten konnten zeigen, dass natürlich vorkommende Moleküle wie S-Milchsäure bzw. deren Ester durchaus in der Lage sind, deutliche asymmetrische Induktionen bei der klassischen Hydroborierung von Carbonylverbindungen zu bewirken, auch wenn unter rein synthetischen Gesichtspunkten die Ausbeuten und ee Werte einem Vergleich mit den katalytischen Hydrierungen von Noyori in keiner Weise standhalten [39, 40]. Unser Interesse galt aber dem Verständnis des Prinzips der Chiralitätsübertragung aus enatiomerenreinen Lösungsmitteln, einem komplexen, facettenreichen und derzeit vitalen Forschungsgebiet.
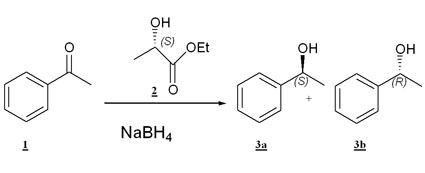
Als experimentelle Sonde für den Lösungsmitteleinfluss untersuchten wir zunächst die Reduktion von Acetophenon 1 mit Borhydriden zu chiralem Phenylethanol 3 in dem relativ günstigen Lösungsmittel S - Milchsäureethylester 2 (Abb 1).
Es wurde zunächst analog einer sehr einfachen und gängigen Arbeitsvorschrift gearbeitet [41]. Das Keton wurde im Lösungsmittel gelöst und das Reduktionsmittel NaBH4 portionsweise zugegeben. Man rührte ca. 2h nach, hydrolysierte mit Wasser und extrahierte mit Ether. Der Extrakt wurde nach
Trocknung gaschromatographisch analysiert.
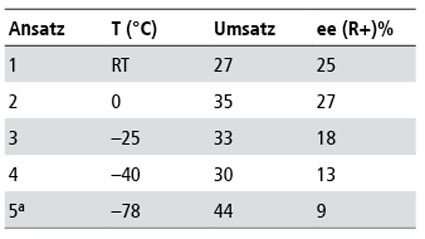
Die ersten Versuche bei Raumtemperatur zeigten spontan chirale Diskriminierung zwischen den beiden möglichen Enantiomeren. Auch wenn die ee Werte mit 13% nicht hoch waren, so waren sie doch deutlich. Versuche bei niedrigerer Temperatur zeigten zwar erwartungsgemäß höhere Selektivitäten bis 17%, aber nicht in dem erhofften Maße. Besonders nachteilig war dabei, dass die Lösungen bei Temperaturen ab -25°C äußerst viskos und kaum rührbar wurden. Eine Verbesserung erbrachte der Einsatz von Boran BH3 THF als Hydrierungsmittel. Die höhere Reaktivität dieses Reagenz führte aber auch dazu, dass die Umsätze mit dem Keton nicht mehr quantitativ waren, sondern die Parallel-Reaktion mit der Hydroxyl-Gruppe des Lösungsmittels an Gewicht gewann, so dass zwar der ee auf 27% gesteigert wurde aber der Umsatz von 100% auf 35% fiel.
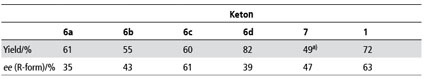
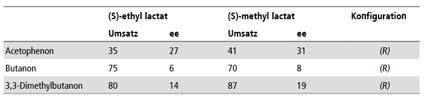
Die weiteren Arbeiten, die auch zwei aliphatische Ketone einschlossen, konnten zeigen, dass allgemein bei tieferen Temperaturen höhere ee Werte erreicht wurden und dass der Methylester der Milchsäure unter allen Bedingungen der Geeignetere war (Tab. 1).
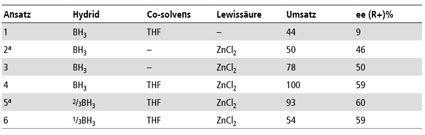
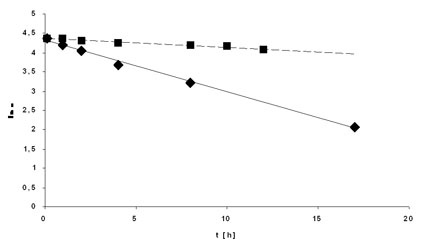
Durch Variation der Boran-Equivalente wurde Einblick in den Mechanismus und die Kinetik der Reaktion gewonnen. Es bestätigte sich, dass die drei Hydride des Borans unterschiedliche Reaktivität aufweisen. Abbildung 2 zeigt die Abnahme der Acetophenon Konzentration mit der Zeit für 1, 2/3 und 1/3 BH3 Äquivalente. Die logarithmische Auftragung zeigt nur für den äquivalenten Ansatz (3-facher Hydridüberschuss) einen linearen Verlauf, für die beiden anderen Ansätze ist ein klarer 2-Geraden-Verlauf zu erkennen. Die jeweiligen Schnittpunkte der Geraden bei 3,5 bzw. 4,2 kennzeichnen eine Änderung der Reaktionskinetik bei 65% Umsatz für den 2/3 Ansatz (doppelter Hydridüberschuß) und 34% Umsatz bei dem 1/3 Ansatz (äquivalente Hydridmenge) (Abb 2).
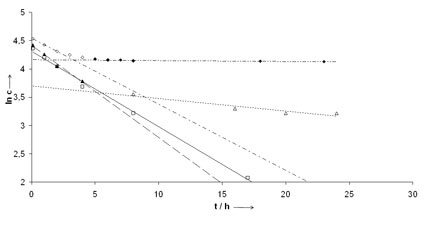
Durch Zusatz von Tetrahydrofuran als Co-Solvens erzielte man auch bei -78°C eine homogene Mischbarkeit, ohne die Induktionskraft nachteilig zu beeinflussen und die Aktivierung der Carbonylgruppe durch lewissaure Katalyse mit ZnCl2 verbesserte deutlich den Umsatz (Abb 3). Während bei der unkatalysierten Reaktion der ee mit sinkender Temperatur unverständlicherweise abnimmt, steigen Umsatz und ee bei der katalysierten Reaktion erwartungsgemäß in dieser Richtung [42]. Auch der Umsatz verbesserte sich, offensichtlich war so die Boran-Addition die kinetisch schnellere Reaktion als die Säure/Base Reaktion mit der Hydroxylgruppe. Eine einheitliche Reaktionsführung bei -78°C mit quantitativem Umsatz und 60% ee für Acetophenon ist bei dreifachem Hydridüberschuss möglich (Tab. 2, 3).
Variation der Parameter
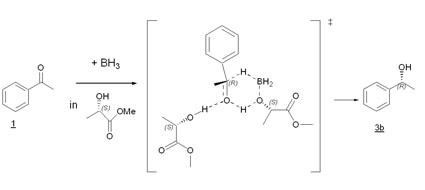
In Zusammenarbeit mit den Professoren Schmidt und Rueping der Universität Frankfurt wurden an Hand von Rechenmodellen die möglichen Übergangszustände und Produktverteilungen für die Raumtemperatur-Reaktionen mit Acetophenon berechnet. Beim Ansatz eines 6-gliedrigen Übergangszustands mit Beteiligung von zwei Molekülen Milchsäureester, wie in Abbildung 4 dargestellt, zeigten die Ergebnisse eine eindrucksvolle Übereinstimmung von Theorie und Praxis. Die berechneten Energiedifferenzen von si- und re-Seiten Angriff forderten einen ee von 37% (R+), was dem experimentell gefundenem von 31% erstaunlich nahe kam [43].
Insoweit hat das umgebende Lösungsmittel und dessen chiraler Käfig wenig Einfluß auf den Reaktionsablauf, nur die direkte Interaktion über Wasserstoffbrücken prägt den ee. Dies ist im Einklang mit den Ergebnissen aller Arbeitsgruppen, die mit CIL eine Induktion erreichten. Auch hier ist das Vorhandensein einer protisch-polaren Gruppe notwendig für die Induktionswechselwirkung.
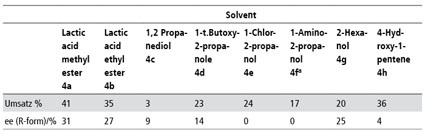
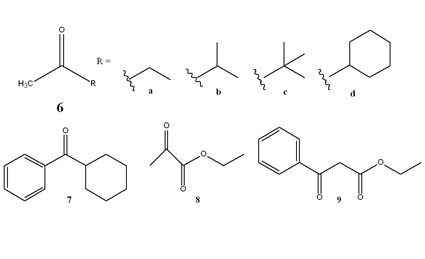
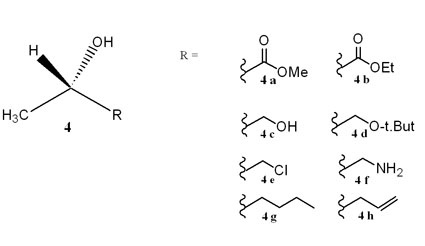
Interessant war daher auch die Frage, wie sich grundsätzlich andere chirale Solventien, die aber ausdrücklich keine chiralen ionischen Flüssigkeiten sein solten, bei der Hydroborierung verhalten würden. Die Umsetzung von Acetophenon zu Phenylethanol diente auch hier als Standardreaktion bei der Prüfung der Induktionsstärke. Bei den eingesetzten Verbindungen wechselte unter Beibehaltung der Strukturelemente Methylgruppe; Wasserstoff und Hydroxylgruppe der vierte Rest des zentralen chiral-substituierten Kohlenstoffatoms (Abb. 5). Interessanterweise konnte von den acht getesteten Lösungsmitteln keines den Milchsäuremethylester übertreffen (Tab. 4). Neben der notwendigen Wasserstoffbrückenbindung zum Chiralitätszentrum könnten daher auch π-π-Wechselwirkungen im Übergangszustand eine Rolle spielen.
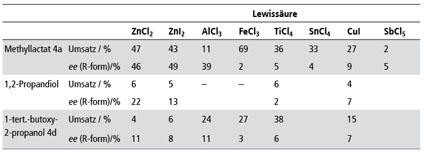
Auch die Rolle und der Einfluss der Lewissäure wurden gründlich untersucht. Durch die systematische Variation diverser Lewissäuren konnten wir zeigen, dass der geeignete Katalysator für die Hydroborierungsreaktion entsprechend der Klassifikation nach Kobayashi schwach und neutral ist [44]; beste Ergebnisse wurden mit ZnCl2 und ZnI2 erhalten. Das galt auch, wenn nicht Milchsäuereester, sondern andere chirale Lösungsmittel verwendet wurden (Tab.5).
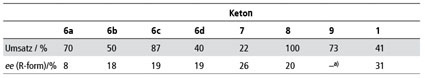
Im Zusammenhang mit den Berechnungen durch die Kollegen der Universität Frankfurt waren schon zwei weitere Ketone untersucht worden; es lag daher nahe, die Anwendungsbreite der Reaktion bezüglich der Ketone in Methyllactat zu untersuchen. Bei den sieben eingesetzten Ketonen (Abb. 6) wurde die Abhängigkeit der Induktion von der Struktur deutlich. Sterisch anspruchsvolle Verbindungen zeigten einen deutlich höheren ee als die einfacheren Vertreter (Tab. 6 und 7). Besonders auffällig war aber die Zunahme des ee bei aromatischen Ketonen - auch wieder ein Hinweis auf eventuell vorhandenes π-stacking [45].
Die ersten Arbeiten hatten die Vorstellung reifen lassen, dass es ggf. einen intensiven Zusammenhang zwischen der Struktur des Lösungsmittels, des prochiralen Ketons und er erzielten Induktion gibt. Strukturell ähnliche Moleküle sollten sich in einen Solvenskäfig besser einpassen und höheren ee erzielen. Aus entropischen Gründen wäre dann im (S)-Lösungsmittel die entsprechende (R)-Form des Gast Moleküls begünstigt. Die Hydroborierung von Ethylpyruvat in Milchsäuremethylester zu Milchsäureethylester zeigt jedoch kein signifikant höheren ee als die vergleichbaren anderen Ketone.
Neben unserer Hydroborierung war - wie oben erwähnt - über Lösungsmittel vermittelte asymmetrische Induktion bei Photoisomerisierung, Nitro-Michael-Addition und Morita-Baylis-Hillman berichtet worden. Um die Anwendung chiraler Lösungsmittel in unterschiedlichen chemischen Reaktionen zu erforschen wurden in einer Art Screening bekannte Synthese-Verfahren in protischen Medien darauf untersucht werden, ob sich Milchsäure oder ein Milchsäurederivat als Solvens eignet und nachfolgend, ob eine Induktion erzielt wird.
Hierfür boten sich die Aldol-Reaktion und die Mannich-Reaktion an; aber auch nucleophile Substitutionen mit prochiralen β-Dicarbonylverbindungen, α-Bromierung von Ketonen sowie die Epoxidierung und die Hydroximercurierung von Alkenen nach Standardverfahren [46].
Auch der Ersatz von Isopropanol durch Methyllactat bei der Meerwein-Ponndorf-Verley (MPV) Reduktion wurde versucht.
Die basisch katalysierte MPV bzw. die Aldol Reaktion, aber auch die Mannich-Reaktion führten in Methyllactat durchweg zu einer Esterspaltung und nachfolgend zu racemischen, teilweise undefinierten, Produktgemischen. Auch bei der Umsetzung von Acetessigester mit Bromethan in Methyllactat wurden nur wenige Prozent Umsatz mit 7% ee von 2-Ethylacetessigester nachgewiesen. Hauptprodukt war eine Substanz mit Molpeak 145 (ggf. M+-1 von 2-Ethoxypropansäureethylester). Auch die α-Bromierung von Propiophenon war mit 7% ee nur mäßig erfolgreich, keine verwertbaren Ergebnisse erhielt man bei der Epoxidierung bzw. der Hydroxymercurierung von Styrol.
Es zeigte sich, dass der Einsatz von Milchsäureestern zur chiralen Induktion eingeschränkt ist. Bei Säure/Base katalysierten Reaktionen ist die Esterspaltung in der Regel schneller. Vor allem bei Aldolreaktionen wird so viel Base verbraucht und anschließend kein Induktionseffekt mehr durch das Salz beobachtet! Grundsätzlich ist eine asymmetrische Induktion aber auch mit anderen chiralen Lösungsmitteln möglich. So konnten wir bei der Aldolreaktion von 2-Nitrobenzaldehyd mit Aceton in kommerziell erhältlichem (S)-3-Octanol bei 70% Umsatz einen ee von 10% erziehlen, ein Wert, der größenordnungsmäßig so auch von Luo bei der Reaktion von Aldehyden mit cyclischen Ketonen in CIL gefunden wird [47].
Zusammenfassend lässt sich sagen, dass der „proof of principle" erbracht worden ist, das asymmetrische Induktion von chiralen Lösungsmitteln ausgehen kann. Für eine praktische Anwendung sind die erzielten Enantiomeren Überschüsse allerdings zu gering und die Möglichkeit zur Induktion ist eingeschränkt und stark von den Reaktionsbedingungen abhängig, wenn das Solvens aufgrund seiner Struktur reaktiv ist.
Literatur ist direkt beim Autoren erhältlich.
Anbieter
Hochschule Darmstadt - Fachbereich Chemie und BiotechnologieHochschulstr. 2
64289 Darmstadt
Deutschland
Meist gelesen

Single-Site Excellence
Interview mit Frank Wegener und Jörg Blumhoff, ESIM Chemicals, über die Wettbewerbssituation und ihre künftige Strategie im weltweiten CDMO-Markt.

Radikaler Schnitt für gesundes Wachstum – CHT stellt sich neu auf
Die CHT Group gehört zu den Hidden Champions der deutschen Spezialchemie.

Auf der Suche nach der richtigen Formel
Europas Stärke liegt in der Verbindung von Prozesswissen, Anwendungskompetenz und Nachhaltigkeit

Schlüsselrohstoff für Industrie und Gesellschaft
Hochreines Salz besitzt für Europa strategische Bedeutung – doch der Markt ist konzentriert.

Continuous Manufacturing ganzheitlich bewerten
Die Investitionsentscheidung für eine kontinuierliche Produktion bedarf einer belastbaren Wirtschaftlichkeitsrechnung entlang des gesamten Prozesses.



