Funktionalisierte Nanopartikel
An der TU Braunschweig werden derzeit magnetische Nanopartikel für ein hochselektives und kostengünstiges Magnetseparationssystem entwickelt.
Gegenwärtig werden magnetische Nanopartikel mit Partikelgrößen zwischen 6 und 25 nm suspendiert in einer Flüssigkeit, als sogenannte Ferrofluide, intensiv hinsichtlich ihrer technischen Nutzbarkeit erforscht. Derartige Fluide werden bereits sehr vielseitig in der Ventil-, Lautsprecher- und Medizintechnik eingesetzt. So werden in der medizinischen Diagnostik beispielsweise Eisenoxid-Nanopartikel als Kontrastmittel für die Magnetresonanztomographie eingesetzt, wobei die magnetischen Partikel eine lokale Störung des Magnetfeldes des Tomographen hervorrufen. Hierdurch kann das Gewebe sichtbar gemacht werden. Durch den Einsatz dieser Magnetit-Kontrastmittel konnte in den letzten Jahren der Nachweis und die Behandlung von Lebertumoren signifikant verbessert werden.
Die herausragenden Eigenschaften dieser Partikel eröffnen auch für die Separation und Aufreinigung pharmazeutischer Produkte aus biotechnologischen Prozessen weitere interessante Forschungsgebiete. Unter anderem werden sie zur Aufreinigung von Antikörpern oder Antigenen eingesetzt, die im Bereich der Krebsdiagnostik und -therapie eine wichtige Rolle spielen. Im Rahmen des Verbundforschungsprojektes „Neuartige Synthese- und Formulierungsverfahren für schwerlösliche Arzneistoffe und empfindliche Biopharmazeutika (SynFoBia)" innerhalb des neugegründeten Zentrums für Pharmaverfahrenstechnik (PVZ) der TU Braunschweig werden derzeit magnetische Nanopartikel für ein hochselektives und kostengünstiges Magnetseparationssystem entwickelt. Dabei werden funktionalisierte magnetische Nanopartikel zur in und ex situ-Aufreinigung von Proteinen aus biotechnologischen Prozessen eingesetzt.
Separationsstrategie
Für das Magnetseparationssystem werden superparamagnetische Eisenoxidnanopartikel zunächst mit Metallkomplex-Gruppen funktionalisiert, die mit einem 6-Histidin-Tag des Zielproteins komplexieren und somit an diesen binden können. Die Funktionsweise des Magnetseparationssystems zeigt Abb. 1.
Funktionalisierte Nanopartikel (in schwarz) werden in das Kultivierungsmedium gegeben, das die aufzureinigenden Zielproteine (in rot) und weitere Nebenprodukte und Verunreinigungen (in blau) enthält. Durch die Anbindung des Zielproteins an die funktionalisierten Partikel und dem Anlegen eines externen Magnetfeldes ist eine magnetische Abtrennung der beladenen beladenen Nanopartikel möglich. Die Verunreinigungen können durch einfaches Waschen mittels einer Hepes-NaCl-Lösung entfernt werden. In einem weiteren Behandlungsschritt wird das Zielprotein durch die Elution mit Imidazol, das die Abspaltung der Proteine von den Partikeln bewirkt, in hoher Reinheit gewonnen. Die anschließende Regeneration der magnetischen Partikel ermöglicht ihre Wiederverwendung und somit eine Kostenminimierung des gesamten Separationsprozesses.
Für das Separationssystem werden hochkristalline Maghemit-Nanopartikel mit einer monomodalen Verteilung und einem Medianwert x50 (v) von 8 nm mittels der so genannten nicht-wässrigen Sol-Gel-Synthese hergestellt. Diese Synthese zeichnet sich durch ihre einfache Reproduzierbarkeit sowie hohe Produktreinheit und Kristallinität der resultierenden Nanopartikel aus. Die in Triethylenglykol hergestellten Partikel zeigen in Wasser nur eine geringe Neigung zur Agglomeration und eignen sich daher sehr gut für biotechnologische Separationsapplikationen. Die Partikel werden anschließend mit einem GNTA-Liganden funktionalisiert. Für diesen wurde zuvor 3-Glycidoxypropyl-trimethoxysilan (Glymo) mit N, N-Biscarboxymethyl-L-Lysin (NTA) gekoppelt. Diese Funktionalisierung führt zu einer Langzeitstabilität der Partikel in Wasser und ermöglicht eine Beladung mit Ni2+-Ionen über die Ausbildung eines Komplexes an den Endgruppen des Liganden. Der 6-Histidin-Tag, der das Zielprotein markiert, kann nun reversibel an den Nickel-Metallkomplex der Partikel koordinieren. Das Protein wird dabei selektiv an die Partikel gebunden. Durch die Zugabe des Nickelsalzes wird eine leichte Agglomeration der Partikel auf eine Clustergröße von etwa 1000 nm erzielt, was eine schnellere magnetische Abtrennung erlaubt. Die durch diesen Prozess hergestellten Partikel ermöglichen eine hochselektive Aufreinigung der Zielproteine, ohne denaturierend auf diese zu wirken.
Biotechnologische Applikation
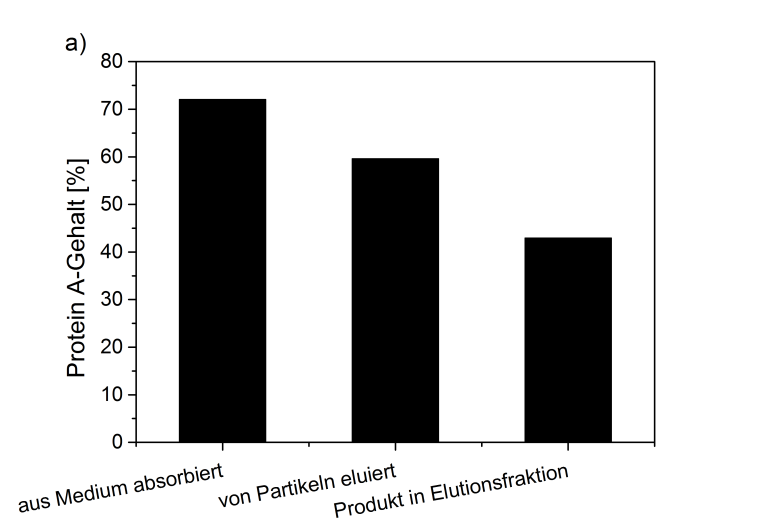
Die Funktion des Magnetseparationssystems wurde zunächst beispielhaft zur ex situ-Aufreinigung von Protein A aus einer Kultivierung von Bacillus megaterium aufgezeigt. Dazu wurden funktionalisierte Partikel in zellfreien Überstand des Kultivierungsmediums gegeben und für 20 min bei Raumtemperatur inkubiert. Im Folgenden wurden die mit dem Zielprotein angereicherten Partikel magnetisch abgetrennt und drei Mal mit einer Hepes-NaCl-Lösung gewaschen. Die Abtrennung der mit Protein A-angereicherten Partikel erfolgte in mit Stahlkugeln gefüllten magnetischen Säulen, die in einem magnetischen Feld positioniert wurden. Die Partikel und das an sie gebundene Protein A werden dabei in der Säule als Retentat zurückgehalten. Das Permeat setzt sich aus den nicht magnetischen Fraktionen des Kultivierungsmediums und der Waschlösung zusammen.
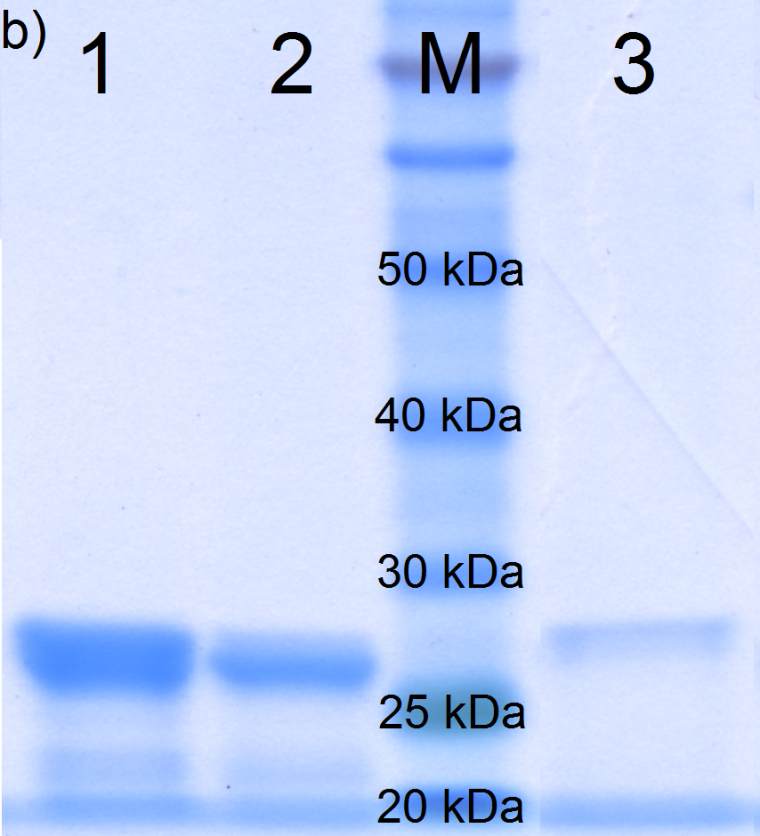
Das an die Partikel gebundene Protein A wird anschließend mit Imidazol von den Partikeln abgespalten und als separate Fraktion aufgefangen. Die Reinheit des gewonnenen Protein A konnte mittels SDS-PAGE mit >99 % (>95 % bei in situ s. u.) bestimmt werden.
Für eine in situ-Aufreinigung der Proteine aus dem Kultivierungsmedium wurden dem Ansatz nach der Induktion von Bacillus megaterium mit Xylose die funktionalisierte Nanopartikel mit einer Konzentration von 1,5 mg Partikel pro ml Kultivierungsmedium zugegeben. Die erzielten Anreicherungs- und Reinheitsergebnisse der Magnetseparation von Protein A sind in Abb. 2 durch SDS-PAGE dargestellt. Die Intensität der Bande der SDS-PAGE wird mit der Menge an gebundenem Produkt durch Verwendung homologer Standards korreliert.
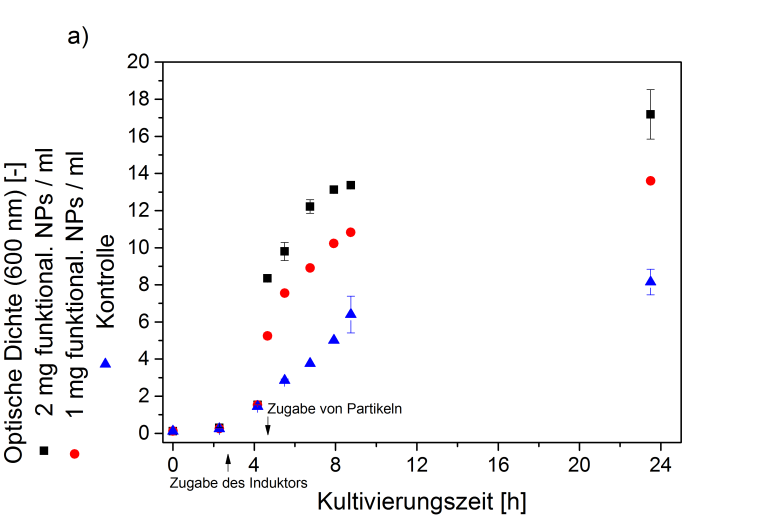
Abb. 3a zeigt das Zellwachstum bestimmt als Optische Dichte (OD) von B megaterium nach Zugabe verschiedener Konzentrationen an funktionalisierten Nanopartikeln aufgetragen über die Kultivierungsdauer. Die Messung der OD ist eine photometrische Methode, die zur Bestimmung der Zelldichte einer Bakterienkultur herangezogen werden kann. Mit Zunahme der im Kulturmedium vorliegenden Anzahl an Zellen, bzw. mit stetigem Zellwachstum, steigt auch die gemessene OD. Werden funktionalisierte magnetische Nanopartikel nach 4,5 h zum Kultivierungsansatz hinzugegeben, nimmt die Optische Dichte erwartungsgemäß sprunghaft zu. Das Wachstum von B. megaterium wird durch die Zugabe der Partikel nur geringfügig eingeschränkt.
Anhand von REM-Aufnahmen (Abb. 3b) zeigt sich, dass die Partikel zwar mit den Zellen von B. megaterium interagieren, es jedoch zu keiner verstärkten Zellagglomeration und keiner signifikanten Inhibierung des Wachstums kommt. Die Menge des sekretierten Zielproteins sowie dessen Reinheit entsprechen den Werten ohne Partikel-Zugabe. Es konnte weiterhin gezeigt werden, dass die in situ-Abtrennung und Aufreinigung des Zielproteins während der Biosynthese durch die funktionalisierten magnetischen Nanopartikeln mit ähnlicher Effizienz und Selektivität erfolgt wie im zuvor erläuterten ex situ-Verfahren.
Grundstein für eine kontinuierliche Produktion
Die Wiederverwendbarkeit der magnetischen Partikel wird derzeitig anhand von Partikelgrößenmessungen und thermogravimetrischer Analyse sowie der Effizienz in weiteren Aufreinigungszyklen evaluiert. Somit ist der Grundstein für eine kontinuierliche Produktion sowie Aufreinigung von Histidin-markierten Proteinen gelegt und könnte zukünftig zum breiten Einsatz der Magnetseparationstechnik in der Biotechnologie führen.










