Uni Bayreuth: Substratbindung an Metallzentren
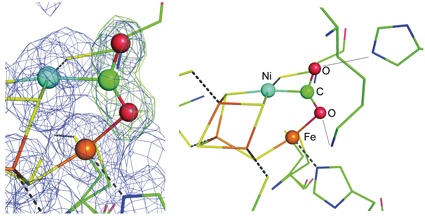
Die biologischen Umsetzungen gasförmiger Substrate, wie Stickstoff, Wasserstoff, Kohlendioxid, Kohlenmonoxid und Methan, sind von zentraler Bedeutung für die biogeochemischen Stoffkreisläufe der Erde. Katalysiert werden diese Reaktionen zumeist von Enzymen mit komplexen eisen- und schwefelhaltigen Metallzentren, die mit weiteren Übergangsmetallen, wie Nickel und Molybdän, vergesellschaftet sein können. Diese Enzyme sind eine Synthese eines sulfidischen Minerals mit einem Polypeptid. Wie die komplexen biologischen Metallzentren ihre gasförmigen Substrate binden und aktivieren, ist noch weitgehend unbekannt, da Komplexe der Metalloenzyme mit ihren Substraten meist instabil sind. Die Bayreuther Biochemiker Jae-Hun Jeoung und Holger Dobbek haben die Struktur des Enzyms Kohlenmonoxid-Dehydrogenase im Komplex mit CO2 genauer untersucht. Die Kristallstruktur zeigt, wie CO2 durch die Bindung an ein Nickel- und ein Eisen-Ion des Enzyms aktiviert wird. Zwei weitere Strukturen der Kohlenmonoxid-Dehydrogenase identifizieren die Bindestelle des Kosubstrates Wasser am Ni, Fe-Zentrum. Im Kontext mit spektroskopischen Untersuchungen ist es nun möglich, einen detaillierten Katalysemechanismus der enzymatischen CO-Oxidation / CO2-Reduktion (CO + H2O ↔ CO2 + 2H+ + 2e-) zu formulieren.












