Reinstwasseranalytik




ReinRaumTechnik - Die Analytik von Rein- und Reinstwasser ist ein sehr umfassendes Thema mit sehr verschiedenen Anforderungen und Grenzwerten in den entsprechenden Industriezweigen. In Atomkraftwerken wird unter anderem der Borgehalt von Reinstwasser ständig überwacht. Metallische Kontaminationen in Reinstwasser für die Halbleiterindustrie gilt es im unteren ppt-Bereich sicher nachzuweisen. Pharmawasser wird besonders auf mikrobiologische Kontaminationen untersucht. Muss in der Spurenanalytik beispielsweise Chlorid im ppt-Bereich nachgewiesen werden, gilt es das ubiquitär vorkommende Chlorid im Eluenten so gering als möglich zu halten. Der weitläufig bekannte Parameter der spezifischen Leitfähigkeit von Reinstwasser von 18,2 MΩ/cm kann deswegen nur ein erster Anhaltspunkt in der Betrachtung der Qualität des untersuchten Reinstwassers darstellen.
In dieser Kurzübersicht werden beispielhaft einige weitläufig bekannte analytische Nachweismethoden für die Untersuchung von Reinstwasser umrissen. Je nach Fragestellung gibt es darüber hinaus zahlreiche Methoden, welche auf den jeweiligen Anwendungsbereich gezielt zugeschnitten sind. In der Molekularbiologie beispielsweise gilt es, Reinstwasser ohne Verunreinigungen mit DNA oder RNA-Fragmenten bereitzustellen. Dieser Parameter wird beispielsweise mit einer PCR-Analytik nachgewiesen.
Folgende vom Fraunhofer IPA durchgeführten Untersuchungen werden unter anderem für die Rein(st)wasseranalytik angewendet:
- Mikrobiologische Kontamination (Bakterien, Pilze, Sporen)
- Gesamtkohlenstoff (anorganisch und organisch)
- Leitfähigkeit als Summenparameter aller ionischen Verbindungen
- Ionenchromatographie zur quantitativen Bestimmung einzelner Ionen
- Gaschromatographie zur quantitativen Bestimmung organischer Verunreinigungen
Auf die Bestimmung des Gesamtkohlenstoffs wird in diesem Artikel nicht näher eingegangen. Dies erfolgt in einer der nächsten Ausgaben.
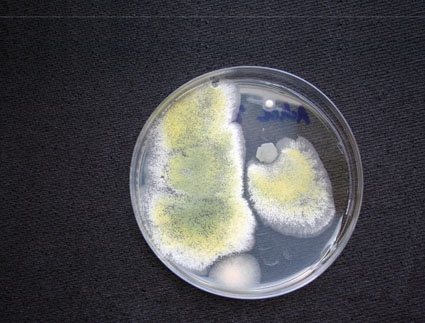
Mikrobiologische Kontaminationen
Vorzugsweise wird dabei ein definiertes Volumen Reinstwasser filtriert (Porengröße = 0,2 μm). Der Filter wird anschließend auf ein Nährmedium gelegt und inkubiert. Nach erfolgter Inkubation werden die Kolonien ausgezählt und ausgewertet, beispielsweise als koloniebildende Einheiten pro Volumen (KBE/ml). Diese Methode ist unter anderem in der Ph.Eur. beschrieben (1). Durch die Verwendung von Selektivnährböden und bestimmten Inkubationsparametern können bestimmte Organismengruppen bevorzugt kultiviert werden. So können Pilze, thermophile (wärmeliebende), kryophile (kälteliebende) aberauch anaerobe Bakterien (Bakterien, welche ohne Sauerstoff wachsen können) selektiv analysiert werden. Wichtig ist dabei jedoch zu wissen, dass hierbei lediglich die kultivierbaren Organismen detektiert werden können. Ein Großteil der vorhandenen lebenden Mikroorganismen ist jedoch nicht kultivierbar (VBNC, viable, but not culturable) (2). Weitere Nachweisverfahren sind die Durchflußzytometrie und der Nachweis von organismenspezifischer DNA. Wasser für Injektionszwecke darf nach Ph.Eur. beispielsweise einen Grenzwert von 10 KBE/100 ml nicht überschreiten (1).
Leitfähigkeit
Durch ein Leitfähigkeitsmessgerät wird die spezifische Leitfähigkeit des Reinstwassers gemessen. Dies stellt eine sehr robuste und kostengünstige Methode dar, welche in Reinstwassersystemen meist standardmäßig online eingesetzt wird. Die gemessene spezifische Gesamtleitfähigkeit addiert sich aus den spezifischen Einzelleitfähigkeiten aller vorhandenen Ionen (Ionenäquivalentleitfähigkeit ; in [S • cm2 • mol-1] oder [Ω-1 • cm2 •mol-1]). Ausgehend von den jeweiligen molaren Ionenleitfähigkeiten kann somit die spezifische Leitfähigkeit einer Salzlösung berechnet werden. Wichtig bei Leitfähigkeitsmessungen ist die Temperatur, welche die zu vermessende Lösung während der Messung aufweist. Bei den meisten Messgeräten wird diese mit erfasst und entsprechend berücksichtigt. Die Ausgabe erfolgt dann auf eine Referenztemperatur, beispielsweise T = 25°C. Bekannt sind folgende Einheiten: der spezifische Widerstand in Ωcm und die spezifische Leitfähigkeit in S • cm-1. Meist wird der Messwert als spezifischer Widerstand angegeben, wobei gilt:
1 S • cm-1 = 1 Ω-1cm-1.
In Tabelle 1 werden beispielhaft die wichtigsten Ionenäquivalentleitfähigkeiten dargestellt (3). Kaliumchlorid (KCl) besitzt
bei 25 °C eine molare Ionenleitfähigkeit von 74 + 76 = 150 cm2 • Ω-1 • mol-1. Eine 1 mM Lösung von Kaliumchlorid (entspricht etwa
Reinstmedien
75 mg/l) weist demnach bei 25 °C eine Leitfähigkeit von 1,5E-4 cm-1 • Ω-1 oder 150 μS/cm auf. In der Praxis ist der ert mit 147 μS/cm leicht geringer aufgrund der Tatsache, dass die Ionenäquivalentleitfähigkeit auf eine theoretische unendliche Verdünnung basiert [Kohlrausch-Gesetz (4) oder Debye-Hückel-Onsager-Theorie (5)]. Grenzwerte für die Leitfähigkeit sind für die verschiedenen Reinstwasserqualitäten u. a. in der Ph.Eur (1)., im Standard ISO 3696 (6) in der IRTS Roadmap (7) und ASTM D1193-06 (8) definiert. Wichtig ist dabei zu beachten, dass Wasser auch im absolut reinen Zustand eine geringe Eigenleitfähigkeit aufgrund dessen Eigenschaft als Ampholyt aufweist. Diese liegt bei etwa 18,2 MΩcm oder 0,55 μS/cm bei 25 °C.
Ionenchromatographie
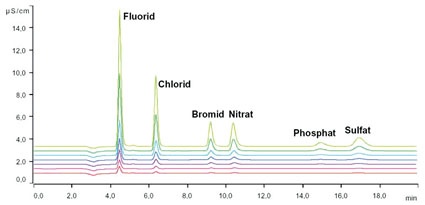
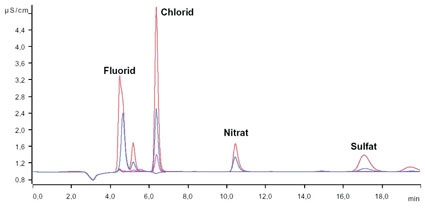
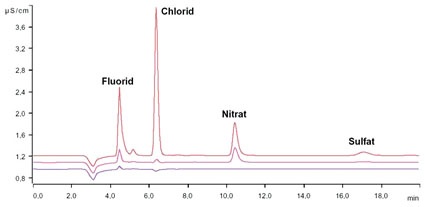
Reicht die Analyse der Leitfähigkeit als Summenparameter aller ionisch vorliegenden Verbindungen in dem zu analysierenden Reinstwasser aufgrund mangelnder Detailtiefe nicht mehr aus, kommt die Ionenchromatographie mit Anreicherung zur Messung von Ionen im ppt-Bereich zum Einsatz. Hierbei wird das zu analysierende Reinstwasser mit Hilfe eines automatisierten Probengebers auf eine Anreicherungssäule gegeben. Alle ionischen Verbindungen (entweder Kationen oder Anionen, je nachdem welche Anreicherungs- und Analysesäule eingebaut ist und welche Methode gefahren wird) werden dabei von der Anreicherungssäule zurückgehalten. Somit kann im Vergleich zu konventionellen Probenschleifen ein viel größeres Probenvolumen analysiert werden aufgrund dessen, dass durch die Anreicherung und anschließende Elution trotz großer zu analysierender Volumina wiederum ein sehr scharfer Peak erreicht werden kann. In der eigentlichen Chromatographie werden die Ionen in der Analysesäule je nach Mobilität zeitlich aufgetrennt und anschließend meist mittels eines hochempfindlichen Leitfähigkeitsdetektors analysiert. Für spezielle Fragestellungen existieren weitere teils selektive Detektionstechnologien, wie u.a. die UV/VIS-Detektion, die amperometrische Detektion und Kopplungstechniken beispielsweise mit einem Massenspektrometer (9). Auf apparative Einzelheiten wie die verwendete chemische Suppression bei der Anionenanalytik soll hier nicht weiter eingegangen werden. Basierend auf einer Kalibration und der ionenspezifischen Retentionszeit (Verweilzeit in der Analysesäule) kann durch einen Flächenvergleich der einzelnen Kurven die Konzentration des jeweiligen Ions bestimmt werden. Exemplarisch wird der Einfluss des Vorlaufs vor der eigentlichen Entnahme aus einer Entnahmestelle der institutseigenen Reinstwasser-Ringanlage mit Hilfe einer Anionen-Chromatographie mit Anreicherung und Leitfähigkeitsdetektion bei chemischer Supression aufgezeigt. Als apparative Ausstattung für die Anionen-Analytik im Spurenbereich wurde ein System basierend aus dem 850 Professional IC zusammen mit dem 858 Professional Sample Processor, zwei 800 Dosino und der Software MagIC-Net (Metrohm AG, Herisau, Schweiz) verwendet (Abb. 2).
Es wurde eine Anreicherung der Anionen mit Leitfähigkeitsdetektion bei chemischer Suppression gewählt. Die Kalibrierkurven wurden mit Hilfe des Probengebers ausgehend von einer Stammlösung und verschiedenen Anreicherungsvolumina automatisiert erstellt. Somit konnte eine sehr hohe Genauigkeit unter Ausschluss möglicher Rückkontaminationen durch ein außen- und innenseitiges Spülen der Probengebernadel nach jeder Injektion erreicht werden. Die Ergebnisse sehen Sie in Tabelle 3.
Reinstmedien
Es konnte gezeigt werden, dass, obwohl die online-Messung bei der Reinstwasseranlage den geforderten Wert von 18,2 MΩ aufzeigte, an einer beispielhaften Entnahmestelle bis zu einer Vorlaufzeit von 5 Minuten verschiedene Anionen nachgewiesen werden konnten. An dieser Entnahmestelle wird eine Vorlaufzeit von zehn Minuten empfohlen, um einwandfreies Reinstwasser zu bekommen. Zur Veranschaulichung: 1 μg/l Chlorid nach fünf Minuten Vorlauf aus einer 1 μg/l Kaliumchlorid-Lösung (entspricht 0,013 μmol/l KCl) ergeben beispielsweise eine theoretische Leitfähigkeit von 0,0024 μS/cm (siehe Tab. 1). Weiterhin spielt der Einfluss der Reinheit der verwendeten Probengefäße eine beachtliche Rolle und muss immer in Blindwertbestimmungen mit analysiert werden. Ionische Verunreinigungen auf technischen Bauteilen (hier exemplarisch eine 4 mm Inbusschraube; 10 mm lang) können mit der Ionenchromatographie hervorragend quantifiziert werden. Generell sollten Glasgefäße für die Spurenanalytik aufgrund des Auslaugens von Ionen durch das sehr aggressive Reinstwasser nicht verwendet werden. Geeignet sind u.a. Gefäße aus hochreinem Polypropylen (PP). Alle PP-Gefäße (Herstellung des Eluenten, Probenhandling und -lagerung) werden ständig in Reinstwasser gelagert, welches in definierten Zeitintervallen getauscht wird.
Gaschromatographie/Massenspektroskopie
Die das Reinstwasser verunreinigenden Moleküle können durch verschiedene Verfahren auf die Säule eines Gaschromatographen (GC) aufgegeben werden. Anhängig von der Eigenschaft der Moleküle (Größe des Moleküls, Wechselwirkung mit der stationären Matrix der Säule u.a.) wandern diese mit unterschiedlicher Geschwindigkeit durch die Säule und gelangen zu verschiedenen Zeitpunkten zum Detektor. Wird als Detektor ein Massenspektrometer (MS) eingesetzt, wird in diesem das zu analysierende Molekül durch beispielsweise Elektronenbeschuss in Bruchstücke zerlegt (fragmentiert). Je nach Verhältnis Masse zur Ladung des Molekülfragmente (meinst einfach geladen) werden diese detektiert. So erhält man zu jeden Zeitpunkt des Chromatogramms aus dem GC ein bestimmtes Spektrum des MS. Folgende Verunreinigungen wurden mit einem angepassten Verfahren nach VDA 278 analysiert: Folgende Aufgabeverfahren können eingesetzt werden:
Flüssiginjektion
Bei dieser Methode wird ein bestimmtes Volumen des zu analysierenden Reinstwassers in einen Gaschromatographen (GC) injiziert und in dessen Injektor verdampft.
Headspace
Dabei wird das Reinstwasser in ein gereinigtes GC-Glasgefäß (Headspace-Gläschen) gegeben und mit einem Septum verschlossen. Es stellt sich dann für jede Komponente ein Gleichgewicht zwischen Flüssigkeit und Gasphase ein. Durch Temperierung kann das Gleichgewicht stark in Richtung Gasphase verschoben werden.Aus dem Gasraum wird dann ein Teil mittels einer gasdichten Spritze entnommen und dem Injektor
des GC zugeführt.
Headspace-Trap
Abweichend zur Headspace-Analytik wird dabei das Gläschen ständig mit Reinstgas (Helium oder Stickstoff u.ä.) gespült. Das Spülgas wird anschließend über eine Kühlfalle geleitet, auf der alle organischen Verbindungen eines bestimmten, von der Kühlfalle abhängigen Spektrums zurückgehalten werden. Nach Beenden des Spülvorgangs wird die Kühlfalle mit bis 40K/s erhitzt. Die zurückgehaltenen Verbindungen werden dabei schlagartig freigesetzt und dem Gaschromatographen direkt zugeführt. Diese Methodik besitzt eine weitaus bessere geringere Nachweisempfindlichkeit als die klassische Headspace-Technik.
Literaturverzeichnis auf Anfrage vom Autoren erhältlich.
Anbieter
Fraunhofer-Institut für Produktionstechnik und Automatisierung IPA
Nobelstr. 1270569 Stuttgart
Deutschland





