Pharmagase für höchste Ansprüche
Phargalis Solutions
An Arzneimittel stellen wir in jeder Hinsicht die höchsten Ansprüche. Daher muss die pharmazeutische Industrie für eine zuverlässige Qualität in der Produktion die Standards der sog. Good Manufacturing Practice (= GMP, dt. Gute Herstellpraxis) einhalten. Das betrifft natürlich auch die zur Herstellung eingesetzten Gase. Dazu bietet Air Liquide mit Phargalis 1 (Stickstoff) ein speziell auf die Bedürfnisse dieser Branche ausgerichtetes Produkt an.
Das Pharmagas Phargalis 1 hält nicht nur hundertprozentig die Vorgaben der geltenden Monographien der EU-Pharmakopöe (Arzneibuch) ein, sondern auch die der US- und der japanischen Pharmakopöe.
Gesetzliche Vorgaben (Monographien) im EU-Arzneibuch
Das Europäische Arzneibuch trifft Festlegungen zu Bereichen, die allgemein in Europa verbreitet sind oder einer einheitlichen Regelung bedürfen. Das Deutsche Arzneibuch enthält ergänzende Regelungen dazu. Darin werden z.B. Analyseverfahren oder (pharmazeutische) Drogen aufgenommen, die nicht in allen Staaten der Europäischen Arzneibuchkommission geläufig sind.
Die Arzneibücher bestehen in der Regel aus einem Allgemeinen Teil, in dem generelle Bestimmungen und Verfahren aus den verschiedenen Bereichen der Pharmazie festgelegt sind, und aus Monographien mit Definitionen, Prüfverfahren auf Identität und Reinheit sowie Lagerungsvorschriften für Drogen und Chemikalien. Eine Monographie gliedert sich dabei in die Abschnitte Anforderungen an Eigenschaften, Identität, Reinheit und Gehalt sowie in eine Sammlung von analytischen Methoden zur Bestimmung dieser letzten drei Größen. Jeder pharmazeutisch eingesetzte Stoff hat die Anforderungen der Arzneibuch-Monographie zu erfüllen.
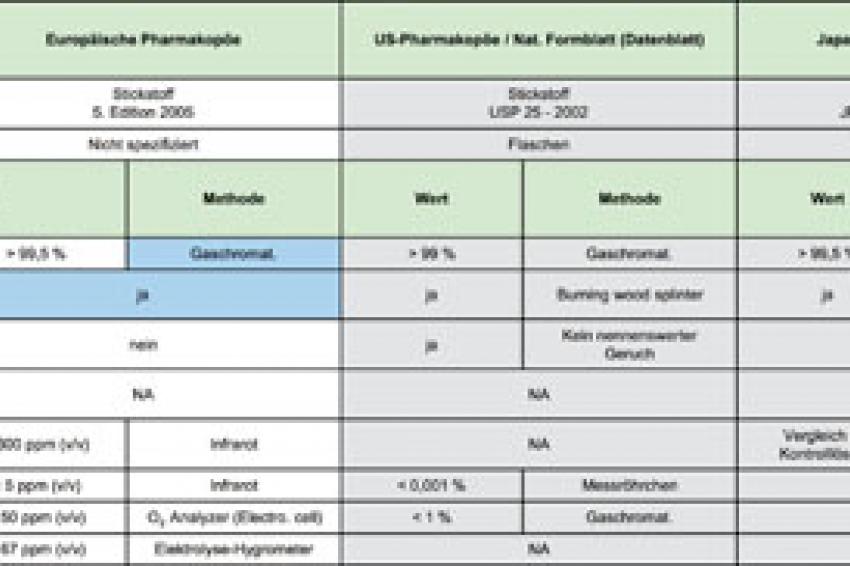
Für das Pharmagas Phargalis 1 gelten die beiden Monographien des EU-Arzneibuchs (2005) 5.0/1247 für die Herstellung und 5.0/1685 für die Aufbewahrung von Fertigarzneimitteln, die auf Sauerstoff besonders empfindlich reagieren. Bei diesen Monographien für Stickstoff (Nitrogenium) werden die Stickstoff-Gehaltsbestimmungen (N2 > 99,5%) und die Analysen der zu überprüfenden Grenzwerte bei Sauerstoff (O2), Kohlenmonoxid (CO), Kohlendioxid (CO2) und Feuchte (H2O) beschrieben (s. Tab.).
IPEC/GxP-konforme Gase als Excipients (Hilfsstoffe)
Die IPEC (International Pharmaceutical Excipients Council) ist eine Dachorganisation mit drei regionalen Vereinigungen in den USA (IPEC-Americas), Europa (IPEC-Europe) und Japan (JPEC). Sie wurde mit dem Ziel gegründet, einen aktiven Beitrag zur weltweiten Verbesserung von Sicherheit und Wirksamkeit von Arzneimitteln zu leisten. Im Rahmen ihrer Aktivitäten strebt die IPEC insbesondere die Harmonisierung von Hilfsstoff-Standards an.
Im Oktober 2007 wurde ein neuer Audit-Guide der IPEC veröffentlicht. Darin ist auch der Vorgang „Stickstoff als pharmazeutisches Excipient (Hilfsmittel) bei direktem Kontakt mit dem Wirkstoff (API = Active Pharmaceutical Ingredients)" beschrieben. Um eine IPEC/GxP-Konformität für das Pharmagas Phargalis 1 sicherzustellen, sind im Vorfeld folgende Hauptaspekte überprüft und validiert worden:
- Validierung von Prozess und Equipment
- Risiko-Analyse (FMEA, HACCP, ...) - Change Control
- Dokumentation
- SOP's (Dokument-Kontrolle) - Ressourcen-Management
- Training und Qualifikation
- Maintenance - Produktumsetzung
- Einkauf
- Produktionsberichte und Bewertungen - Qualitätskontrolle
- In-Process und Endprodukt-Kontrolle - Non-Conformity-Management / Verbesserungen
- OOS-Handling
Wie wird aus technischem pharmazeutischer Stickstoff?
Bei Stickstoff hat die technische Qualität eine Reinheit von bis zu 99,999 Vol.%, die Restbestandteile sind bis auf Sauerstoff nicht spezifiziert. Die pharmazeutische Qualität muss nur eine Reinheit von mindestens 99,5 Vol.% aufweisen, allerdings sind zusätzlich definierte Grenzwerte für Sauerstoff, Kohlenmonoxid, Kohlendioxid und Feuchte einzuhalten. Der entscheidende Unterschied zum technischen Gas besteht daher in der Sicherheit pharmazeutisch validierter Prozesse mit entsprechender Dokumentation und Chargen-Rückverfolgbarkeit sowie der Anwendung aufwendiger Analyseverfahren laut Festlegung im Europäischen Arzneibuch. Dies dient dazu, Gefahren für Patienten durch Qualitätsmängel auszuschließen.
Bei der Entwicklung des Pharmagases erfüllt Air Liquide durch standardisierte und validierte Prozesse von der Herstellung über die Abfüllung bis hin zur Anlieferung die entsprechenden Vorgaben der EU-Pharmakopöe. Vor jeder Anlieferung - ob in der Gasflasche oder im Tankwagen (Abb. 2) - wird eine Analyse (und zusätzlich eine vorgegebene Bestimmung des Stickstoffgehalts) gemäß den N2-Monographien durchgeführt (Abb. 3). Zu jedem Lieferschein erhält der Empfänger ein Analysenzertifikat. Des Weiteren sichert Air Liquide eine vollständige Rückverfolgbarkeit von der Produktion bis zur Lieferung sowie die Unterstützung der Kunden bei Dokumentation und Zertifizierung von Pharmagasen bei Audits zu.
Service ist das A und O
Ergänzt wird Phargalis 1 durch ein entsprechendes Serviceangebot. Neben umfangreichen POU-Analysen an den Entnahmestellen der Gasversorgungssysteme oder direkt an der Stickstoff-Tankanlage (Sumpfanalyse), ist auch ein Zugang zum Pharma-Kompetenzcenter des Unternehmens verfügbar, das Lösungen bei der Einbindung von Pharmagasen in die Produktionsprozesse beim Kunden bietet.
So müssen beispielsweise in der Bio-Pharma-Produktion (Fermentation von Biomasse zur Herstellung von APIs) zur Einhaltung der FDA-Richtlinien immer häufiger die erzeugten Lösungen vor jedem weiteren Prozessschritt - z.B. vor der Gefriertrocknung - vom Qualitätsmanagement geprüft und untersucht werden. Da dies bis zu mehrere Wochen dauern kann, ist es erforderlich, biopharmazeutische Produkte wie Proteinlösungen, Impfseren usw. zuvor schnell und kontrolliert einzufrieren. Um eine stabile und aktivitätserhaltende Kaltlagerung der biologisch aktiven Bestandteile bei - 80°C sicherzustellen, bietet Air Liquide als Lösung das kryogene Pelletieren an, das sich schon bei der Herstellung von Starterkulturen bewährt hat (Abb. 4).
Auf Anfrage sind natürlich auch weitere Gase wie Sauerstoff, Argon und Kohlendioxid in Pharmaqualität gemäß den jeweils gültigen Richtlinien der EU-Pharmakopöe erhältlich.
Wachsende Anforderungen
Die Einführung neuer internationaler Vorgaben mit dem Ziel einer erhöhten Anwendungs- und Patientensicherheit hat die „Messlatte" für die Zulassung und Produktion von Arzneimitteln in den letzten Jahren deutlich erhöht. Diese Vorgehensweise hat sich so bewährt, dass Ähnliches auch für pharmazeutische Gase als Excipients (Hilfsmittel) implementiert wurde - und zwar in allen Bereichen, von der Produktion bis zum Vertrieb. Mit Know-how, Erfahrung und einem weltweiten Netzwerk ist Air Liquide nahe am Markt und den Kunden - immer bereit für neue Herausforderungen.
GxP = bezeichnet alle Richtlinien der „guten Arbeitspraxis". Das „x" steht stellvertretend für den spezifischen Anwendungsbereich, z.B. GMP = Good Manufacturing Practice oder GDP = Good Distribution Practice
SOP = Standard Operating Procedure =
Arbeitsanweisungen
OOS = Out Of Specifications = außerhalb der Spezifikation
HACCP = Hazard Analysis and Critical Control
Points = Gefahrenanalyse und kritische Lenkungspunkte
FMEA = Failure Mode and Effects Analysis = Fehler-Möglichkeits- und Einflussanalyse
POU = Point of Use
FDA = Food and Drug Administration, USA
Kontakt
Air Liquide Deutschland GmbH
Hans-Böckler-Straße 33
40476 Düsseldorf
Deutschland
+49 211 6699-0
+49 211 6699-111